Voici une conférence donnée à l’invitation de Consilium Scientific le 18 mai 2023, organisée par Leeza Osipenko. Consilium joue un rôle essentiel dans la remise en question de la qualité des preuves dont nous disposons en médecine, en particulier pour ce qui concerne les essais cliniques randomisés contrôlés (ECR). Ces derniers mois, ils ont été à l’origine d’excellentes contributions, consultables sur leur site web. Mon intervention a été suivie d’un temps de questions/réponses qui a comporté son moment de suspense.
Comme nous le faisons habituellement, Bill James et moi avons aussi enregistré une version de cette conférence qui me semble assez efficace.
Cette conférence reprend des idées que l’on retrouve plus développées dans le travail de Sander Greenland, qui contient cette phrase mémorable : D’abord, ne pas nuire au savoir.
Adaptée par nos soins, cela donnerait : Ne transforme pas ce qui est bon en poison.
Ariane Denoyel, l’auteur de Génération Zombie, est l’auteur de la version française de cette conférence avec l’aide de Bruno Harle de qui vient la phrase originale – Evident Based Medicine – Voir False Friends. La version anglaise de cette conférence est ici – God Does not Play Dice.
Abel Novoa, de No Gracias, a rédigé une version espagnole et ajouté quelques diapositives supplémentaires – Dios no juega a los dados ¿Deberían hacerlo los médicos?
Nous parlons souvent de ce qui peut être perdu dans la traduction, mais la traduction peut également découvrir des choses et nécessite souvent bien plus que la traduction de mots – en conséquence, j’ai utilisé le mot l’auteur plutôt que traducteur.
Einstein
On sait qu’Einstein a déclaré un jour : “Dieu ne joue pas aux dés.” En France, le jeu de dés a donné naissance à la théorie des probabilités, laquelle a ensuite contribué à créer ce que nous appelons aujourd’hui les statistiques médicales. Il y a 75 ans, nous avons appliqué les statistiques médicales à la création d’essais contrôlés randomisés (ECR). Ces essais servent à évaluer les paris que nous prenons sur les médicaments. Les ECR ont conduit à la “médecine fondée sur les preuves”, Evidence-Based Medicine (EBM). Lorsqu’ils prescrivent un medicament – donc lorsqu’ils lancent un dé – les médecins se fient à l’EBM.
Ont-ils raison d’avoir ainsi confiance en elle ?
Slide 2: Cinquante ans après le premier ECR, en 1998, Don Schell, un solide retraité du pétrole vivant dans le Wyoming, a été mis sous paroxétine pour un problème de sommeil mineur. Quarante-huit heures plus tard, il a tiré sur sa femme, sa fille et sa petite-fille, puis a retourné l’arme contre lui-même. Son gendre survivant a intenté une action en justice contre GlaxoSmithKline (GSK) – le procèsTobin contre SmithKline.
Dans l’affaire Tobin, on a demandé à Ian Hudson, directeur chargé de la sûreté du médicament chez GSK : “Les ISRS – la famille d’antidépresseurs à laquelle appartient la paroxétine, la fluoxétine (Prozac), etc. – peuvent-ils provoquer le suicide ?” Il a botté en touche en évoquant les règles de l’EBM, règles auxquelles GSK se plie, ce qui signifie que l’entreprise fonde ses opinions sur des essais contrôlés randomisés (ECR) – qui utilisent les probabilités pour déterminer la vérité.
Un jury de 12 personnes ordinaires, sans expérience dans le domaine de la santé, a fait primer l’évidence sur la “médecine fondée sur les preuves” brandie par Ian Hudson. Leur diagnostic, leur verdict, était : il était évident que la paroxétine était responsable et que GSK était coupable de négligence. Le jury a préféré la médecine fondée sur l’évidence plutôt que l’Evidence-based medicine.
Pourtant, c’est le point de vue de Hudson qui s’est imposé. Il reste aujourd’hui dominant, jusqu’aux plus hautes sphères du régulateur britannique des médicaments, dont Ian Hudson est par la suite devenu directeur général – ainsi qu’au sommet des autorités sanitaires : la FDA, l’EMA et autres régulateurs.
Slide 3: L’argument brandi par Hudson trouve son origine 70 ans plus tôt, dans le travail d’un homme étrange – Ronnie Fisher. Sur cette photo, vous voyez Fisher fumant une pipe. Plus tard, quand un lien a été établi entre le tabagisme et le cancer du poumon, Fisher ne l’a pas cru. Les preuves n’étaient pas son point fort.
C’est donc encore plus étonnant que ses opinions, proférées voici plusieurs décennies, aient encore un impact si fort sur la façon dont nous pensons et vivons aujourd’hui. C’est à cause de deux facteurs : la randomisation et la significativité statistique.
Fisher n’était pas médecin et n’a jamais dirigé d’essai clinique randomisé. Les essais contrôlés et la randomisation étaient là avant lui, mais son livre The Design of Experiments (Les méthodes statistiques adaptées à la recherche scientifique) les a rendus incontournables.
Fisher essayait de déterminer les caractéristiques de la connaissance, de l’expertise. Nous disposons tous d’expertise. Par exemple, sur les parachutes : tout le monde sait que si on embarque 40 personnes dans un avion, en ne donnant un parachute qu’à 20 d’entre eux, et qu’on les pousse tous dans le vide, ceux qui portent des parachutes survivront et les autres mourront. Fisher confirme que c’est vrai et notre expertise commune en la matière est validée.
Mais des facteurs auxquels on n’a pas pensé pourraient entrer en jeu, par exemple la présence dans le groupe dépourvu de parachute d’une personne dotée de pieds palmés pourrait faire une petite différence sur le résultat final : une personne du groupe sans parachute pourrait survivre.
De même, si une bourrasque providentielle permet à un participant sans parachute d’atterrir sain et sauf sur des arbres couverts de neige – c’est arrivé – cela peut changer le résultat. Mais même si, parmi les 20 personnes sans parachute, l’une survit, nous ne dirons pas que l’expert s’est trompé et que les parachutes ne servent à rien. Alors il faudrait peut-être décider d’une valeur à partir de laquelle les fluctuations liées au hasard ont peu de chances d’expliquer la différence entre les deux groupes.
On doit donc procéder à une randomisation : une répartition aléatoire des participants dans les groupes, pour tenir compte des facteurs comme les pieds palmés ou la bourrasque salvatrice. Le livre de Fisher a érigé cette randomisation en une méthode d’une puissance presque mystique – qui prétend nous aider à vaincre l’ignorance. Et nous faisons confiance à cette méthode pour nous faire connaître la vérité en matière de médicaments.
Mais la randomisation ne peut pas faire disparaître l’effet de la variable « ignorance ».
Slide 4: L’expert vu par Fisher est un Robin des Bois qui 19 fois sur 20 peut fendre une flèche déjà logée au cœur de la cible. L’expertise est précise.
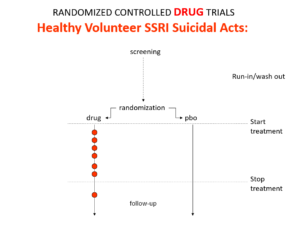
Slide 5: Les essais cliniques randomisés réalisés pour homologuer des médicaments, en particulier des antidépresseurs, ressemblent à ceci plutôt qu’au cœur de cible transpercé par Robin des Bois. Rater la cible à ce point-là indique que nous n’avons pas affaire à de l’expertise.
Slide 6: Tony Hill a dirigé le premier essai randomisé contrôlé de l’histoire de la médecine en 1947, pour voir ce que donnait l’antibiotique streptomycine sur la tuberculose. Hill a ensuite fait connaître le rôle du tabagisme dans le cancer du poumon. Il n’avait pas de temps à perdre avec Fisher et ses théories. Il savait aussi que les médecins n’étaient pas des experts. Son essai clinique n’était pas la démonstration d’une expertise. Il a utilisé la randomisation comme méthode d’allocation équilibrée au sein des groupes – et non pour tenter de maîtriser des inconnues improbables.
L’essai clinique de Hill en a découvert moins sur la streptomycine qu’un essai antérieur non randomisé de la clinique Mayo, qui a montré qu’elle peut provoquer la surdité et qu’une tolérance se développe rapidement.
Slide 7: Dans une conférence de 1965, Hill a fait un sort aux essais randomisés. Il a remarqué que ceux qui les promeuvent le plus activement sont les firmes pharmaceutiques.
Hill ne pensait pas que les essais devaient être randomisés. Il pensait que le fait d’instaurer un « double aveugle » – le patient ignore s’il reçoit la substance active ou le placebo et le médecin qui le suit n’en sait rien non plus – pouvait empêcher les médecins d’évaluer un médicament. Il croyait en la médecine basée sur l’évidence plutôt qu’en la médecine basée sur les preuves.
Quinze ans auparavant, en 1950, le même Hill avait déclaré que nous avions besoin d’essais randomisés pour déterminer si quelque chose fonctionnait. Pourtant, dès 1960, nous disposions de beaucoup de nouveaux médicaments très efficaces, mais aucun n’avait été découvert par des essais randomisés. Il aurait fallu déterminer quel médicament marchait le mieux. Or ce n’est pas une réponse que les essais randomisés peuvent donner – et d’ailleurs la notion de meilleur médicament n’a pas vraiment de sens. La panacée n’existe pas, il faut toujours un parti-pris clinique pour estimer quel médicament va vous convenir à vous.
Hill a également déclaré que les ECR produisent des effets moyens, qui ne sont pas très utiles pour aider le médecin à décider ce qu’il faut faire pour le patient en face de lui. Ils peuvent être utiles pour savoir si un médicament a ou non un effet sur un problème bien ciblé.
Hill dit bien cela, dans la citation que vous voyez : les essais randomisés peuvent aider à évaluer un effet d’un médicament, ce qui signifie qu’ils ne sont pas un bon moyen d’évaluer un médicament dans son ensemble. Tous les ECR génèrent de l’ignorance, mais nous pouvons tirer le meilleur parti de ce défaut si nous le gardons bien à l’esprit. Hill n’a jamais envisagé que les ECR remplaceraient le jugement clinique.
Slide 8: Cet essai de 1960 dirigé par Louis Lasagna illustre parfaitement la réflexion de Hill. L’essai montre que la thalidomide a une efficacité thérapeutique en tant que somnifère, mais il n’a pas repéré qu’elle provoque des dysfonctions sexuelles – comme celles qui surviennent à cause des antidépresseurs ISRS – des tendances suicidaires, de l’agitation, des nausées et des neuropathies périphériques.
Deux ans plus tard, Lasagna était à l’origine de l’exigence d’essais randomisés dans une loi – le FDA Act de 1962 – afin d’éviter que ne survienne un autre scandale comme celui de la thalidomide. Il est donc devenu le premier responsable de l’utilisation des ECR. Paradoxalement, le mécanisme qu’il a imposé pour éviter un nouveau scandale de la thalidomide est celui même qui a permis à cette molécule d’arriver sur le marché. Plus que quiconque, Louis Lasagna est responsable de la généralisation des ECR dans le médicament.
Slide 9: Beaucoup de gens prétendent que rien ne vaut un essai clinique randomisé pour démontrer un lien de causalité entre une substance et un effet.
Pourtant on a vu apparaître pendant les années 1950 les meilleurs antihypertenseurs, hypoglycémiants, antibiotiques et psychotropes de l’histoire de la médecine – le tout sans l’apport d’ECR.
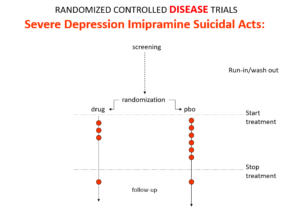
L’imipramine, le premier antidépresseur, est beaucoup plus puissant que les ISRS. Il peut traiter la dépression grave, dite « mélancolique » – les ISRS en sont incapables. Cette dépression s’accompagne d’un risque de suicide multiplié par 80.
L’imipramine a été lancée en 1958. Lors d’un colloque en 1959, des experts ont fait remarquer que même s’il s’agissait d’un traitement merveilleux, il rendait certaines personnes suicidaires. Arrêtez le médicament et la tendance suicidaire disparaît. Réintroduisez-le et la suicidalité revient. C’était ça, la médecine fondée sur l’évidence.
Voici une synthèse de résultats d’un essai clinique comparant l’imipramine à un placebo dans la dépression mélancolique. On s’attendrait à ce que les points rouges indiquant les tentatives de suicide soient moins nombreux avec l’imipramine, parce que même si l’imipramine peut provoquer des suicides, elle améliore l’état des personnes atteintes de cette maladie à haut risque. Cette image pourrait ainsi être interprétée comme une preuve que l’imipramine ne peut pas provoquer le suicide.
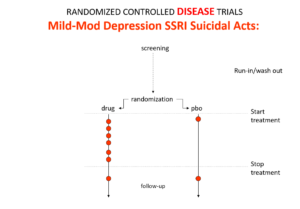
Slide 10: Dans les essais sur la dépression légère à modérée qui ont permis de mettre les ISRS sur le marché, on voit une augmentation des événements suicidaires par rapport au placebo. En effet, chez ces personnes présentant un risque de suicide faible voire inexistant, l’effet suicidogène du médicament apparaît plus clairement.
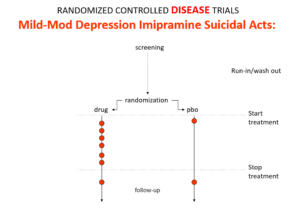
Slide 11: Dans ces essais sur la dépression légère, quand on utilise l’imipramine comme comparateur, on peut observer que l’imipramine provoque, elle aussi, des suicides.
Ces conclusions diamétralement opposées découlent de la différence entre les essais cliniques de traitement, sur des personnes déprimées, et les essais de médicaments, sur des volontaires sains. Si la maladie et le traitement produisent des effets assez similaires, les essais randomisés créent de la confusion au lieu de clarifier la situation. Ce principe se vérifie pour la plupart des maladies et pour leurs traitements.
Lorsqu’un patient devient suicidaire dans un essai, vous devez utiliser votre jugement clinique pour comprendre ce qui se passe. Sauf que dans les ECR, les cliniciens ne sont pas censés utiliser leur jugement.
Slide 12: Voici à quoi ressemble un essai de médicament, mené sur des « volontaires sains », des gens qui ne sont pas malades. En menant des études sur des volontaires sains dans les années 1980, les entreprises ont découvert que les ISRS rendaient les volontaires suicidaires, créaient des dépendances et provoquaient des dysfonctionnements sexuels. Lorsque ces médicaments ont été lancés, personne ne nous a parlé de ces problèmes. C’est en partie parce que les essais de médicaments – donc sur les volontaires sains – ont permis aux entreprises de concevoir les essais de traitement – donc sur les malades – pour masquer ces problèmes.
Slide 13: Il y a plus de décès sous ISRS que sous placebo dans les essais, mais les ECR, comme Ian Hudson vous l’a dit, montrent que les médicaments fonctionnent. C’est parce que leur efficacité est mesurée par des critères de substitution, des paramètres secondaires. Pour les antidépresseurs, c’est l’échelle d’évaluation de la dépression de Hamilton. Quinze ans après l’avoir créée, Max Hamilton a commenté sa propre échelle :
« Il se peut que nous assistions à un changement aussi révolutionnaire que l’était l’introduction de la standardisation et de la production de masse dans l’industrie manufacturière. Les deux ont leurs côtés positifs et négatifs. »
Hamilton considérait son échelle comme une liste rassemblant les questions à poser lors d’un entretien – ce qui comporte du positif et du négatif.
Slide 14: Que veut-il dire ? Eh bien, l’échelle de Hamilton comprend des questions sur le suicide, le sexe, le sommeil, l’appétit et l’anxiété, facteurs qui peuvent tous être affectés par la maladie, la dépression, et par le traitement. Si Leeza participe à un essai clinique pour un ISRS, que je lui demande si elle a ressenti des pulsions suicidaires la semaine dernière et qu’elle dit oui, je devrai évaluer cet item à 4 – alors que si c’est le médicament qui a causé ces pulsions, je devrai marquer 0. Mais les chercheurs ne sont pas autorisés à recourir à leur propre jugement – la valeur par défaut est la maladie, donc on présume que c’est toujours la maladie qui provoque ces pulsions, pas le médicament. Le processus est algorithmique – il ne peut y avoir aucune trace de jugement humain là-dedans.
Slide 15: Cette image provient du télescope James Webb. Les intervalles de confiance ont été introduits par Gauss en 1810 pour résoudre un problème de télescope. À l’époque, les télescopes étaient moins performants, leurs mesures comportaient des marges d’erreur, alors les astronomes n’arrivaient pas à établir s’il y avait une ou deux étoiles dans leur objectif. Comme les erreurs de mesure se répartissent de façon « normale », c’est-à-dire gaussienne, statistiquement, il suffisait de construire un intervalle de confiance ; les mesures qui tomberaient en dehors de ces valeurs provenaient probablement d’une autre étoile.
Les intervalles de confiance ont été introduits en médecine dans les années 1980.
Slide 16: En plus de la randomisation, Fisher a popularisé la notion de « statistiquement significatif ». En 1980, tous les principaux statisticiens médicaux disaient que nous devions nous débarrasser de la notion de « statistiquement significatif » au profit des intervalles de confiance. Les intervalles de confiance sont plus appropriés pour les erreurs de mesure, mais est-ce bien ce type d’erreurs qui se trouvent dans les essais de traitement ?
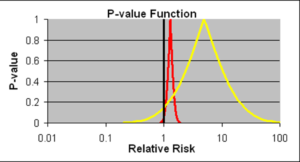
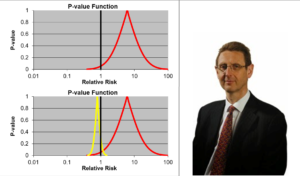
Slide 17: Les intervalles de confiance permettent d’estimer la taille d’un effet et la précision avec laquelle on la connaît. Voici deux intervalles de confiance pour deux médicaments différents, un médicament jaune et un rouge, qui peuvent tous deux provoquer un problème létal – ils peuvent vous tuer.
Les deux intervalles de confiance tombent sur le côté droit de la ligne noire verticale à 1.0, ce qui indique bien que les deux substances causent un problème : une augmentation du risque relatif de mourir.
L’intervalle de confiance pour la substance rouge est très serré et précis et au moins 95 % des données tombent à la droite de cette ligne 1.0, ce qui revient à dire que c’est statistiquement significatif.
Les données sur la probabilité de mourir à cause du médicament rouge sont plus précises que pour le jaune.
Dans le cas du médicament jaune, il semble qu’il y ait un plus grand risque mais il y a une distribution plus large et moins de 95 pour cent des données – plus de 19 sur 20 – tombent à droite de la ligne 1.0.
La sagesse conventionnelle est que si nous mettions juste quelques personnes de plus dans les essais du médicament jaune, nous serions en mesure d’établir un intervalle de confiance plus serré et nous saurions vraiment ce qui se passe, et si on nous demandait de prendre l’une de ces deux substances mortelles, la sagesse conventionnelle, Ian Hudson, la FDA et l’OMS disent que le seul médicament dangereux ici est le rouge, donc vous devez prendre le jaune, dont nous ne savons pas s’il provoque la mort.
Mon point de vue, bien sûr, est tout le contraire. Si on m’obligeait à prendre l’une des deux substances, je choisirais la rouge parce que l’estimation la plus probable du risque de mourir avec le médicament jaune est beaucoup plus élevée mais je vais vous montrer dans un instant que tout ce raisonnement est erroné. C’est pourtant ce qui sous-tendait le raisonnement de Ian Hudson dans le procès Tobin. Et pendant un siècle, des voix faisant autorité nous ont affirmé qu’il ne fallait pas présumer connaître le lien entre des données comme celles-ci et la vie réelle.
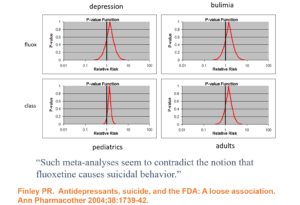
Slide 18: En 1991, face aux affirmations que le Prozac a causé le suicide, Lilly a repris les analyses de ses ECR et a présenté les intervalles de confiance ici comme preuve que le Prozac ne provoque pas le suicide. C’est la pensée de Ian Hudson – il n’y a pas de problème car rien n’est statistiquement significatif.
D’éminents experts comme Sander Greenland disent que c’est faux – et qu’il serait préférable de lire ces valeurs p comme des intervalles de compatibilité – dans cette analyse, les données sont largement compatibles avec le fait que le Prozac provoque des événements suicidaires.
Le point le plus important, c’est qu’il nous faut accepter que depuis un siècle, les statisticiens nous ont prévenus qu’on ne peut pas présumer que les données statistiques correspondent à ce qui se passe dans le monde réel.
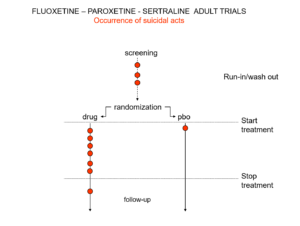
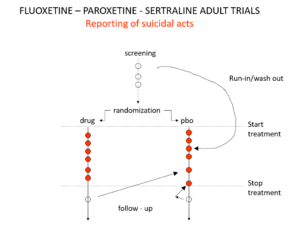
Slide 19: Voici une représentation des événements suicidaires au sein des essais mettant sur le marché le Prozac, le Seroxat et le Zoloft vers 1990. Notez les événements survenus pendant la période de vérification, le screening. Cette période correspond à un temps de sevrage (wash-out) de 2 semaines avant le début d’un essai, une quinzaine au cours de laquelle les personnes arrêtent leurs traitements antérieurs avant de recevoir le nouveau traitement ou le placebo. Cette phase d’un essai est dangereuse – les gens sont en sevrage et peuvent devenir suicidaires.
Slide 20: Lors de la soumission des données à la FDA, les entreprises ont déplacé les événements comme vous le voyez ici. Leur argument était que les personnes en phase de screening, de wash-out, n’étaient pas sous traitement actif – ce qui équivaut à être sous placebo. Il y avait d’autres manœuvres à la fin des essais comme vous le voyez ici.
Même avec ces manœuvres, il y avait un excès d’événements suicidaires sous ISRS, mais l’intervalle de confiance à 95 % n’était plus à droite de 1,0. Pourquoi faire ceci? Parce que les régulateurs et les entreprises ont besoin d’un mécanisme Stop-Go, un seuil de décision, et que la notion de « statistiquement significatif » le fournit. Mais les médecins n’ont pas besoin d’un tel mécanisme externe pour remplacer leur jugement clinique, alors pourquoi acceptons-nous cela ?
Slide 21: Personne n’a remarqué ces manœuvres en 1990, mais 14 ans plus tard, alors que les cas d’enfants devenant suicidaires sous ISRS ont soulevé de vifs débats, des questions ont été posées aux fabricants. GSK et Pfizer ont répondu :
“GSK n’a intentionnellement soumis aucune information erronée ou trompeuse à la FDA. Les données sur le suicide soumises à la FDA ont explicitement identifié le moment où les événements se sont produits pendant la période de rodage du placebo. La FDA disposait de toutes ces informations depuis le début. »
“Le rapport de Pfizer de 1990 à la FDA montre clairement… que 3 tentatives de suicide ont eu lieu pendant les phases de placebo en simple aveugle… La FDA n’a ni critiqué ces données ni le rapport comme étant inappropriées, ni exigé des analyses supplémentaires.”
Ces manœuvres enfreignent les réglementations de la FDA. Le personnel de la FDA a noté cette violation, mais les hauts responsables de la FDA l’ont ignorée et ont même mis leur nom sur des articles qui englobaient ces violations de la réglementation – en utilisant des chiffres illégitimes pour affirmer que les ECR contrôlés par placebo n’étaient pas contraires à l’éthique, car ceux sous placebo n’étaient pas plus à risque que ceux sous traitement.
La FDA et les entreprises ont collaboré étroitement au cours de la crise du suicide en 1990. Criminellement ? Peut-être. Je préfère l’idée que la FDA adoptait une position d’ignorance stratégique.
Il y a ici une crise dans la production des connaissances. Ce n’est pas un sujet sur lequel la FDA prendra les devants – ce sont des bureaucrates. Les entreprises créent désormais des connaissances ou des apparences de connaissances. Alors que ce sont les médecins qui devraient se trouver à la source des connaissances médicales. Mais il semble qu’ils étaient portés disparus vers 1991.
Slide 22: Le principe universel des ECR est que la randomisation permet de contrôler tous les facteurs de confusion possibles dans tous les univers possibles. Alors que la randomisation introduit des facteurs de confusion dans les essais cliniques.
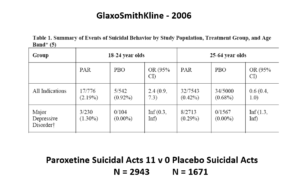
Les images des 3 diapositives suivantes proviennent d’un document GSK préparé en 2006 pour être soumis à la FDA. Les petits caractères sont difficiles à lire – le gras en bas vous donne les détails-clés.
Les données sur les événements suicidaires concernant la paroxétine dans les essais sur le trouble dépressif majeur dans cette diapositive montrent qu’elle provoque des événements suicidaires. Mais la randomisation est sur le point de venir à la rescousse de GSK.
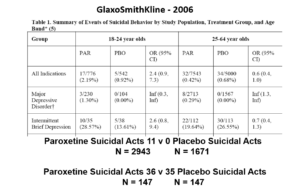
Slide 23: Ici, vous voyez que GSK a réalisé 2 essais chez des patients atteints de troubles dépressifs brefs intermittents (IBDD), des personnes qui font régulièrement des tentatives de suicide. La paroxétine n’a pas bien fonctionné – un essai a même dû être arrêté. Pourquoi le fabricant a-t-il mené de tels essais ?
Slide 24: Lorsque vous additionnez les chiffres des deux essais, hop ! la paroxétine protège soudainement contre le suicide. Vous devez d’abord savoir que les patients atteints d’IBDD peuvent être admis aux essais sur le trouble dépressif majeur – nous n’avons aucun moyen de les distinguer. Certains patients deviennent catalogués IBDD en vertu d’une mauvaise réponse à un ISRS.
Ce scénario peut se produire chaque fois qu’une maladie est hétérogène – comme le diabète, la démence, la maladie de Parkinson, le cancer du sein, les maux de dos, l’hypertension et la plupart des pathologies. Dans ces cas, la randomisation masquera les effets, bons comme mauvais – et nous permettra d’utiliser un problème causé par un médicament pour masquer un autre problème causé par un médicament.
Slide 25: Graphiquement, l’équivalent de la substance rouge ici est la courbe de dépression majeure seule – plus de 95% des données sont à droite de la ligne 1.0. La sagesse traditionnelle est que l’ajout de quelques événements supplémentaires aux essais du médicament rouge devrait nous donner une version plus précise de la même estimation.
En ajoutant environ 3 % de plus dans ce cas, nous avons déplacé la courbe vers le côté opposé de la ligne 1,0. C’est un intervalle de confiance plus précis mais cette précision témoigne de notre ignorance plutôt que d’une meilleure connaissance. Aucun livre de statistiques médicales ne fait jamais allusion à cette possibilité.
Nous pourrions ajouter 40 événements suicidaires au bras IBDD paroxétine avant que GSK n’ait à admettre que la paroxétine cause un problème – sur la base que les résultats sont maintenant statistiquement significatifs.
Les intervalles de confiance ne nous aident pas à déterminer ce qui se passe dans ces cas. Ils n’aident pas non plus dans les réponses hétérogènes aux médicaments. Si nous clonons un David qui est sous sédation par un médicament rouge et un Ian Hudson qui est stimulé par celui-ci, la meilleure estimation de l’effet du médicament rouge se situera sur la ligne 1,0, montrant apparemment que ce médicament n’a aucun effet sur le sommeil. Une méthode pour distinguer entre une et deux étoiles ne devrait pas produire une réponse qu’il n’y a pas d’étoiles. Les jugements algorithmiques ne peuvent se substituer à un jugement humain.
Slide 26: Revenons au télescope James Webb pour résumer tout cela. Les intervalles de confiance étaient une étape sur la voie de la révélation de l’individualité des étoiles. En médecine aujourd’hui, les approches statistiques opèrent contre l’individualité.
Nous pensons que l’utilisation du hasard pour contrôler le biais est scientifique et nous permettons donc à des algorithmes stupides de remplacer le jugement clinique. La médecine clinique, comme le droit, et les 300 premières années de la science, ont utilisé le biais pour contrôler le hasard. La médecine clinique doit réaffirmer la validité de cette approche.
Slide 27: L’opinion selon laquelle les ECR offraient le moyen le plus scientifique d’établir si un médicament avait des effets indésirables a émergé en 1983, comme l’indique cette citation de Rossi et al :
Le signalement spontané est « la méthode de détection des nouveaux effets indésirables la moins sophistiquée et scientifiquement rigoureuse. . . »
Louis Lasagna, l’homme qui en 1962 plus que quiconque a imposé les ECR, a répondu :
Cela peut être vrai dans l’un des sens du mot sophistiqué (en anglais), c’est-à-dire « falsifié », mais je soutiens que les rapports spontanés sont plus « élaborés, conscients, subtils et intellectuellement attrayants » que les ECR grandioses et coûteux.
Slide 28: En 1990, dans cet article de Teicher et coll., 3 cliniciens ont affirmé que la fluoxétine avait rendu 6 personnes suicidaires. Suivant les approches cliniques traditionnelles pour déterminer la causalité, cet article a établi sans aucun doute que la fluoxétine pouvait amener certaines personnes à devenir suicidaires.
Beaucoup d’autres groupes ont rapporté des résultats similaires. J’ai publié 2 cas d’hommes qui ont été médiqués, démédiqués puis remédiqués avec un ISRS. La seule façon d’expliquer ce qui s’est passé était que la fluoxétine en était la cause. C’était la médecine fondée sur des preuves.
Slide 29: Presque la même semaine que la sortie de mon article, le BMJ a publié un article dans lequel Lilly affirmait qu’une analyse de leurs ECR n’a montré aucune preuve que le Prozac rendait les gens suicidaires. Les cas signalés, par conséquent, ont-ils dit, étaient regrettables mais anecdotiques – et plusieurs anecdotes ne constituent pas une donnée. La dépression était le problème, pas la fluoxétine. Les essais cliniques sont la science des causes et des effets. Le défi pour les médecins et les autres était de savoir si nous allions croire la science ou les anecdotes ?
Ce fut un moment de création de connaissances qui a probablement bénéficié de la contribution de toutes les entreprises et peut-être de la FDA. Cet article a créé la médecine basée sur les preuves et, tout comme pour les ECR 30 ans plus tôt, les personnes qui exhortent le plus souvent les médecins à pratiquer l’EBM aujourd’hui sont les sociétés pharmaceutiques.
En fait, la phrase originale est le pluriel d’anecdotes fait des données – sinon Google ne fonctionnerait pas.
L’idée que la maladie est responsable de tentatives de suicide et de suicides chez des volontaires sains est difficile à croire, mais les entreprises peuvent faire appel à des experts pour l’affirmer.
L’article de Teicher est la science – les données de Lilly sont un artefact. La question que je vous pose est la suivante : qui allez-vous croire, la Science ou l’Artefact ? L’approche fondée sur des algorithmes, combinée à des statistiques inappropriées, crée des artefacts et non de la science.
Lilly a trafiqué les données. Lorsque vous obtenez les données « brutes » de l’essai, vous pouvez réconcilier la médecine fondée sur les preuves et la médecine fondée sur l’évidence – comme vous pouvez vous y attendre avec la vraie science. Une incompatibilité ne serait pas un problème pour la vraie science, qui progresse en résolvant les divergences.
Lilly, cependant, n’était pas dans l’état d’esprit d’embrasser les divergences. Leur posture était dogmatique – quasi religieuse. Ils nous interdisent de croire à l’évidence de nos propres sens.
Peter Drucker, le gourou du marketing, a déclaré que le but du marketing n’est pas de vendre plus de Prozac mais de détenir le marché. C’est à ce moment que l’industrie a pris possession du marché.
Cette situation permet aux entreprises de dicter quels sont les risques, les avantages et les compromis des médicaments. Cela leur permet de nous forcer à vivre la vie qu’ils veulent que nous vivions plutôt que de s’engager de produire des produits qui nous aideront à vivre la vie que nous voulons vivre – une entreprise risquée et peu rentable.
La médecine consiste traditionnellement à tirer le meilleur parti de l’utilisation d’un poison. Lilly et d’autres entreprises empoisonnent la santé des personnes qui se portent volontaires pour des essais cliniques. Ils se rendent responsables de l’une des violations les plus graves de la méthode scientifique depuis plus de 360 ans que la science existe.
Slide 30: Qu’est-ce que la science? Les livres d’histoires en Angleterre commencent souvent avec la fondation de la Royal Society en 1660. Elle a établi les règles de base – la science traiterait des questions qui pourraient être réglées par les données. Les participants pouvaient être chrétiens, hindous, juifs, musulmans ou athées, mais ils étaient appelés à laisser ces appartenances à la porte et à parvenir à un consensus sur la meilleure façon d’expliquer le résultat expérimental présenté devant leurs yeux.
Les histoires de la science mettent l’accent sur le mot Données. L’idée de s’accorder est plus importante. Les statistiques ne jouaient aucun rôle là-dedans. Les expériences étaient des événements qui n’avaient pas besoin de descriptions statistiques. La science ne remplace pas le jugement par un artefact statistique – cela n’a commencé qu’il y a 33 ans.
Slide 31: En 1618, Walter Raleigh fut exécuté à Londres – pour avoir été trop proche des Français et des Espagnols. Raleigh a été reconnu coupable sur la base de choses dites à son sujet par des personnes qui ne se sont pas présentées au tribunal pour être entendues et interrogées par la défense.
Le système judiciaire a ensuite reconnu l’injustice de ce procédé et a imposé des règles de preuve. Le ouï-dire ne pouvait pas être utilisé comme preuve. Les jurés – mettons un groupe de 12 personnes, chrétiens, hindous, musulmans, athées et juifs – ne peuvent fonder un verdict que sur les éléments qui leur sont présentés et qui peuvent être interrogés par l’accusation et par la défense. Le processus consistant à forcer 12 personnes avec des préjugés très différents à se prononcer sur ce qui se trouve devant elles est l’essence même de la science.
Les verdicts et les diagnostics sont provisoires, ce qui peut sembler contraster avec l’objectivité de la science, mais les opinions scientifiques sont également provisoires. Les scientifiques tentent de renverser les faits jusque-là établis grâce à de nouvelles données.
Disons que j’ai donné de la fluoxétine à Leeza il y a 33 ans et qu’elle est devenue suicidaire. Je pourrais l’examiner et la contre-interroger, faire des laboratoires et des scanners, augmenter la dose, arrêter le médicament, ajouter un antidote, conférer avec vous tous pour voir si nous pouvons expliquer cela d’une autre manière. Elle est la donnée, le lieu dans lequel se déroule l’expérience.
Si Leeza, moi et vous concluons que la fluoxétine l’a rendue suicidaire et signalez cela à la MHRA ou à la FDA, la première chose que la FDA fera sera de supprimer son nom. Personne ne peut maintenant l’interroger et parvenir à une opinion scientifique sur l’existence d’un lien ou non. Sa blessure a été faite par ouï-dire – désinformation.
Si vous êtes plus tard blessé de la même manière et voyez des dizaines de milliers de rapports de suicidalité sur les ISRS dans le système de notification des événements indésirables de la FDA, vous ne pouvez pas porter cela devant les tribunaux car personne ne peut être traduit en justice. Ce sont des ouï-dire, pas des preuves.
Les ECR menés par l’industrie sont également des ouï-dire et ne doivent pas être présentés au tribunal comme preuve. Accéder aux données signifie accéder à des personnes – comme Leeza ou moi – et nous ne pouvons pas le faire avec des sujets dans des essais de l’industrie, qui souvent n’existent pas. Les articles qui sont issus de ces essais sont écrits par des fantômes et les auteurs, qui n’ont vu aucun des patients, ne peuvent pas non plus parler de ce qui s’est passé.
En revanche, si Leeza et moi rapportons son cas dans un journal médical en tant qu’étude de cas clinique, avec nos noms dessus, c’est une preuve et nous pouvons tous les deux être traduits en justice.
Slide 32: En 1997, vous avez ici Lasagna, faisant écho à Tony Hill 30 ans plus tôt, qui dit :
Contrairement à mon rôle dans les années 1950 qui consistait à essayer de convaincre les gens de faire des essais contrôlés, maintenant je me retrouve à dire aux gens que ce n’est pas le seul chemin vers la vérité.
La médecine fondée sur les preuves est devenue synonyme d’ECR, même si ces essais échouent invariablement à dire au médecin ce qu’il veut savoir, quel médicament est le meilleur pour Mme Dupont ou M. Durand – et non ce qui arrive à une personne moyenne, qui n’existe pas.
Slide 33: Depuis environ 1980, les ECR ont créé un scénario où les médicaments ont des avantages et non des problèmes. Cela conduit à la polymédication.
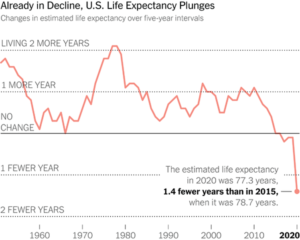
En 2016, plus de 40 % des plus de 45 ans aux États-Unis prenaient 3 médicaments ou plus chaque jour de l’année. Plus de 40 % des plus de 65 ans prennent 5 médicaments ou plus chaque jour de la semaine. Et parallèlement à cela, l’espérance de vie, notamment aux États-Unis, est en baisse.
La réduction de la prescription de médicaments peut augmenter l’espérance de vie, réduire les hospitalisations et améliorer la qualité de vie.
Slide 34: La déprescription est la principale tâche médicale de notre époque. Mais réduire le nombre de médicaments n’est pas facile, comme l’illustre cette image du film Démineurs (The Hurt Locker). Beaucoup de ces médicaments « explosent » quand on tente de les retirer. Si ce médecin croit la littérature médicale, il est mort.
Aucun RCT n’aidera jamais pour cette tâche. La meilleure preuve résidera dans l’expérience clinique de la prise en charge de situations similaires. Pouvoir parler à des collègues cliniciens aidera, mais le partenaire scientifique-clé est le patient – qui apporte des indices, par exemple sur ce qui se passe quand ils oublient un comprimé, et qui sont les seuls à savoir ce que leur font les médicaments. Le patient est le lieu dans lequel l’expérience se déroule. Chaque patient et sa réponse aux médicaments sont uniques.
Slide 35: Nous avons commencé avec Einstein. Ein Stein signifie une pierre – une forme. Jusqu’à présent, nous n’avons pas eu de mathématiques qui pourraient contrer la moyenne que nous obtenons des statistiques médicales.
Les mathématiques concernent davantage les formes que les nombres et plus tôt cette année, une nouvelle forme a été découverte, la première forme apériodique unique – cela signifie qu’elle ne peut pas être incorporée dans d’autres formes ou moyennes. Cela nous offre une nouvelle mathématique solidement individuelle – un meilleur modèle pour la pratique clinique que le lancer de dés.






















Author
First, do not harm knowledge.
Adapted by us, this would give: Do not turn what is good into poison.
We often talk about what can be lost in translation, but translation can also discover things and often requires much more than translating words – as a result, I used the word author rather than translator.
“moment of suspense”
recovery&renewal Retweeted
Dan Johnson
@DanJohnsonAB
·
May 28
Replying to @DanJohnsonAB and @DrLeslieCarr
Actually, “the side effects are minimal.” is true, because GSK, Eli Lilly, etc can only kill each child once. It’s not like they can kill each one dozens of times. Just once, so nobody cares. What’s one life, compared to shareholder profits and MD quick convenience? Nothing,
Always remember the last thing you read, that had a profound effect
https://amazingdexterjohnson.com/
What happened to the amazing Dexter Johnson?